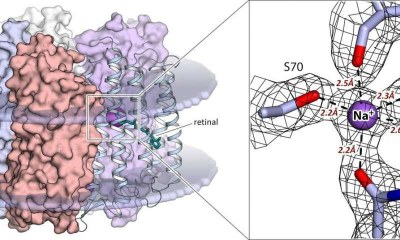
Figura. Esquerra: pentàmer de la rodopsina KR2 en el seu estat actiu en la membrana cel·lular (dos discos horitzontals). Dreta: Lloc d'unió del sodi en el centre actiu de la proteïna. Les distàncies als àtoms d'oxigen que coordinen el sodi es donen en àngstroms, o deumilionèsimes de metro. La xarxa negra és el mapa de densitat electrònica. L'esfera violeta denota un ió de sodi. Crèdit: Kirill Kovalev
Cerdanyola del Vallès, 9 de septembre de 2020. Un equip d'investigació internacional format per investigadors del Moscow Institute of Physics and Technology (MIPT, Rússia); La Universitat de Grenoble i l'European Synchrotron Radiation Facility (França); el Jülich Research Center, l'Aachen University, el Max Planck Institute of Biophysics, I l'European Molecular Biology Laboratory (Alemanya); així com el Sincrotró ALBA, ha obtingut per primera vegada l'estructura de la proteïna sensible a la llum i bomba de sodi KR2 en el seu estat actiu. El descobriment aporta una descripció del mecanismo després de la transferència impulsada per llum de l'ió sodi a través de la membrana cel·lular. L'article es va publicar a Nature Communications.
La KR2 és membre d'una gran família de rodopsines microbianes - proteïnes sensibles a la llum presents a la membrana cel·lular dels arqueus, bacteris, virus i eucariotes. Aquestes proteïnes tenen un ampli rang de funcions, incloent-hi el transport de ions impulsat per llum a través de la membrana. Aquests canals i bombes d'ions són les eines principals de l'optogenètica, un camp en auge de la biomedicina centrat a controlar les cèl·lules del cos il·luminant-les amb llum.
L'optogenètica va guanyar rellevància a causa de les seves contribucions a tècniques mínimament invasives per a la investigació del cervell i tractaments de trastorns degeneratius dirigits a Alzheimer, Parkinson i altres malalties. Més enllà d'això, l'optogenètica permet revertir la pèrdua de visió i oïda i restaurar l'activitat muscular.
Malgrat els seus molts èxits, millorar el desenvolupament de l'optogenètica es complica a causa del nombre limitat de proteïnes disponibles que siguin adequades per a l'activació i inhibició cel·lular. Per exemple, l'eina optogenètica més utilitzada, la canalrodopsina 2, l'estructura es va reportar originalment a la revista Science per part d'investigadors i graduats del MIPT, pot transportar ions de sodi, potassi i calci, així com protons. La baixa selectivitat de la proteïna porta a efectes secundaris indesitjats en les cèl·lules. Com a resultat, optimitzar els protocols per utilitzar eines ontogèniques és actualment costós i requereix molt temps.
La cerca de proteïnes noves i més selectives és una prioritat per a l'optogenètica. Una de les candidates, la rodopsina KR2 descoberta en 2013, és una eina única que únicament transporta de forma selectiva ions de sodi a través de la membrana sota condicions fisiològiques. Entendre com funciona la KR2 és crucial per optimitzar les característiques funcionals de la proteïna i utilitzar-la com a base per a noves eines ontogèniques.
Biofísics de l'MIPT van publicar les primeres estructures de la KR2 en les seves diverses formes en 2015 i 2019. Entre altres coses, van mostrar que la proteïna s'organitza en pentàmers a la membrana, i que aquest comportament és vital per al seu funcionament.
Malgrat això, tots els models descrits fins ara han observat la proteïna en el seu estat inactiu o fonamental. No obstant això, és només en el seu estat actiu- després de ser il·luminada- quan la proteïna transporta realment el sodi. Per entendre com funciona la bomba KR2, els investigadors han obtingut i descrit ara la seva estructura en alta resolució en el seu estat actiu.
"Vam començar utilitzant l'aproximació tradicional, activant la KR2 en cristalls de proteïna precrescuts il·luminant amb un làser i prenent una instantània de l'estat actiu congelant ràpidament els cristalls a 100 Kelvin," explica el primer autor de l'estudi, l'estudiant doctoral del MIPT Kirill Kovalev. "Vam tenir sort, perquè aquest tipus de manipulacions poden destruir els cristalls. Per evitar-ho, vam haver de calibrar de forma precisa la longitud d'ona i la potència del làser i trobar el temps d'exposició òptim.”
Produir el gran nombre de cristalls de rodopsina KR2 d'alta qualitat necessari per als experiments ha estat possible gràcies a l'equipament exclusiu del Centre d'Investigació per a Mecanismes Moleculars d'envelliment i Malalties Associades a l'Edat del MIPT.
La troballa més significativa de l'estudi és identificar els residus d'amino àcid de la proteïna que s'uneixen a l'ió de sodi a l'interior de la molècula KR2. Són el factor que determina la selectivitat de la rodopsina cap a un tipus d'ions en particular. A més, una estructura d'alta resolució per a l'estat actiu de la proteïna a 2,1 àngstroms- 21 centèsimes mil-milionèsimes- ha revelat la configuració precisa del lloc d'unió de l'ió de sodi en el centre actiu de la proteïna. Per primera vegada, l'equip va mostrar que el lloc d'unió de la KR2 s'ha optimitzat per als ions de sodi en el curs de l'evolució de la rodopsina. Això vol dir que l'estructura obtinguda en l'estudi per a l'estat actiu és més adequada per al disseny racional de la següent generació d'eines optogenètiques basades en KR2.
"Durant el nostre treball, també vam obtenir l'estructura de l'estat actiu de l'KR2 a temperatura ambient," afegeix Kovalev. "Per aconseguir-ho, vam haver d'actualitzar els ja ben coneguts protocols per recopilar dades cristal·logràfiques. A més, utilitzem fonts de radiació de sincrotró per treure partit a les tècniques cristal·logràfiques en sèrie, que estan creixent en popularitat ara mateix."
En concret, es van obtenir dades de cristal·lografia de mil·lisegons en sèrie de l'estat O de la KR2 a temperatura ambient en la línia de llum XALOC del Sincrotró ALBA.
L'estructura de la KR2 a temperatura ambient va confirmar que el model de proteïna produït a partir de la instantània a baixa temperatura és correcte. Això va aportar una demostració directa que la congelació criogènica no va afectar l'estructura interna de la rodopsina.
Les estructures reportades en l'article han permès als científics aportar per primera vegada una descripció del transport actiu impulsat per llum de l'ió sodi a través de la membrana cel·lular. En concret, l'estudi mostra que el transport de sodi implica molt probablement un mecanisme híbrid compost per transport de protons en relleu i difusió passiva d'ions a través de les cavitats polars en la proteïna. El mecanisme proposat pels investigadors s'ha confirmat a través d'estudis funcionals de formes mutades de KR2 i simulacions de dinàmica molecular de l'alliberament de l'ió sodi de la proteïna.
"El transport d'ions a través de la membrana cel·lular és un procés biològic fonamental. Dit això, el transport de l'ió sodi hauria de ser possible gràcies a un mecanisme diferent de l'involucrat en el de transport de protons", explica Valentin Gordeliy, el director d'investigació a l'institut de Grenoble per Biologia Estructural i coordinador científic del Centre d'Investigació per a mecanismes Moleculars d'Envelliment i Malalties Associades a l'Edat de l'MIPT. "Per primera vegada, hem vist com un ió de sodi s'enllaça a l'interior de la molècula de rodopsina i hem comprès el mecanisme per a l'alliberament d'ions a l'interior de l'espai intracel·lular."
Els biofísics estan convençuts que els seus descobriments no només revelen els principis fonamentals en què es basa el transport iònic a través de la membrana, sinó que a més serà d'utilitat per a l'optogenètica. El MIPT contínua amb el desenvolupament de formes optimitzades de la proteïna KR2 per expandir les eines per a la investigació del cervell i les teràpies contra malalties neurodegeneratives.
Referència: Kirill Kovalev et al. Molecular mechanism of light-driven sodium pumping, Nature Communications (2020). DOI: 10.1038/s41467-020-16032-y
Enllaç a la noticia original: https://phys.org/news/2020-05-biophysicists-reveal-optogenetic-tool.html




